Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka. Seperti diketahui, zat utama dalam cuka adalah asam asetat. Basa (alkali) berasal dari bahasa Arab yang berarti abu.
Seperti halnya dengan sabun, basa bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami pergantian). Rasa pahit merupakan salah satu sifat zat yang bersifat basa.
Kita dapat mengenali asam dan basa dari rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk mengidentifikasi asam dan basa yang baik dan aman dapat dengan menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik. Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi (II) klorida (FeCl2).
Tabel beberapa contoh asam
| Nama Asam | Rumus Kimia | Terdapat dalam |
| Asam asetat | CH3COOH | Larutan Cuka |
| Asam askorbat | C6H8O6 | Jeruk, tomat, sayuran |
| Asam sitrat | C6H8O7 | Jeruk |
| Asam borat | H3BO3 | Larutan pencuci mata |
| Asam karbonat | H2CO3 | Minuman berkarbonasi |
| Asam klorida | HCl | Asam lambung |
| Asam nitrat | HNO3 | Pupuk, peledak TNT |
| Asam fosfat | H3PO4 | Deterjen, pupuk |
| Asam tartrat | C4H6O6 | Anggur |
| Asam malat | C4H6O5 | Apel |
| Asam formiat | HCOOH | Sengatan lebah |
| Asam laktat | C3H6O3 | Keju |
| Asam benzoat | C6H5COOH | Bahan pengawet makanan |
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan,
yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah, maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.
2.Basa
Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik. Beberapa produk rumah tangga seperti deodoran, obat maag (antacid) dan sabun serta deterjen mengandung basa.
Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH.
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida.
Tabel beberapa contoh Basa
| Nama Basa | Rumus Kimia | Terdapat dalam |
| Alumuinium Hidroksida | Al(OH)3 | Deodoran, obat maag |
| Kalsium hidroksida | Ca(OH)2 | Plester |
| Magnesium hidroksida | Mg(OH)2 | Obat pencahar (antacid) |
| Natrium hidroksida | NaOH | Sabun, pembersih saluran air |
Orang mengalami sakit perut disebabkan asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl) digunakan antacid. Antacid mengandung basa yang dapat menetralkan kelebihan asam lambung (HCl).
Umumnya zat-zat dengan sifat yang berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru. Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.
Ion-ion ini akan bergabung membentuk senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga reaksi penggaraman karena membentuk senyawa garam.
Mari kita simak contoh reaksi pembentukan garam berikut!
Asam + Basa —> Garam + Air
Asam klorida + Natrium hidroksida —> Natrium klorida + air
HCl (aq) + Na OH (aq) —> Na Cl (aq) + H2O (ℓ)
Asam Basa Garam Air
Walaupun reaksi asam dengan basa disebut reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam dan basa penyusunnya.
Garam yang berasal dari asam kuat dan basa kuat bersifat netral, disebut garam normal, contohnya NaCl dan KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya adalah CH3COONa.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Tabel beberapa contoh garam
| Nama Garam | Rumus Kimia | Nama Dagang | Kegunaan |
| Natrium klorida | NaCl | Garam dapur | Penambah Rasa |
| Kalsium karbonat | CaCO3 | Kalsit | Bahan cat |
| Kalium nitrat | KNO3 | Salpeter | Pupuk |
| Kalium karbonat | K2CO3 | Potas | Bahan sabun |
| Natrium fosfat | Na3PO4 | TSP | Bahan detergen |
| Amonium klorida | NH4Cl | Salmoniak | Bahan baterai |
Ketika seseorang mencari ikan dengan menggunakan ”setrum” atau aliran listrik yang berasal dari aki, apa yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik?
Sebenarnya air murni adalah penghantar listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat yang larut dalam air dan dapat membentuk suatu larutan yang menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya adalah larutan gula dan larutan urea.
Untuk mengetahui suatu larutan dapat menghantarkan arus listrik atau tidak, dapat diuji dengan alat penguji elektrolit. Alat penguji elektrolit sederhana terdiri dari dua elektroda yang dihubungkan dengan sumber arus listrik searah dan dilengkapi dengan lampu, serta bejana yang berisi larutan yang akan diuji. Mari kita lakukan kegiatan berikut untuk mengetahui apakah asam, basa, dan garam dapat menghantarkan arus listrik.
B. Identifikasi Asam, Basa, dan Garam
Banyak sekali larutan di sekitar kita, baik yang bersifat asam, basa, maupun netral. Cara menentukan sifat asam dan basa larutan secara tepat yaitu menggunakan indikator. Indikator yang dapat digunakan adalah indikator asam basa. Indikator adalah zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat menggunakan kertas lakmus dan larutan indikator atau indikator alami.
Berikut adalah beberapa cara menguji sifat larutan.
1. Identifikasi dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam, larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut adalah sebagai berikut.
a. Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.

2. Identifikasi Larutan Asam dan Basa Menggunakan Indikator Alami
Cara lain untuk mengidentifikasi sifat asam atau basa suatu zat dapat menggunakan indikator alami. Berbagai bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit, kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam basa. Ekstrak atau sari dari bahan-bahan ini dapat menunjukkan warna yang berbeda dalam larutan asam basa.

Sebagai contoh, ambillah kulit manggis, tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka dalam larutan asam terjadi perubahan warna dari ungu menjadi cokelat kemerahan. Larutan basa yang diteteskan akan mengubah warna dari ungu menjadi biru kehitaman.
C. Penentuan Skala Keasaman dan Kebasaan
1. Kekuatan Asam dan Basa
Kekuatan suatu asam atau basa tergantung bagaimana senyawa tersebut dapat diuraikan menjadi ion-ion dalam air. Peristiwa terurainya suatu zat menjadi ion-ionnya dalam air disebut ionisasi. Asam atau basa yang terionisasi secara sempurna dalam larutan merupakan asam kuat atau basa kuat. Sebaliknya asam atau basa yang hanya terionisasi sebagian merupakan asam lemah atau basa lemah.
Jika ingin mengetahui kekuatan asam dan basa maka dapat dilakukan percobaan sederhana. Perhatikan nyala lampu saat mengadakan percobaan uji larutan elektrolit. Bila nyala lampu redup berarti larutan tergolong asam atau basa lemah, sebaliknya apabila nyala lampu terang berarti larutan tersebut tergolong asam atau basa kuat.
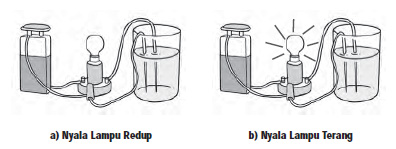
Asam kuat atau asam lemah pada konsentrasi yang sama menghantarkan listrik yang berbeda. Nyala lampu pada Gambar (a) tampak redup. Ini berarti larutan yang diuji berupa asam lemah atau basa lemah. Adapun pada Gambar (b) lampu menyala terang, menandakan bahwa larutan yang diuji berupa asam kuat atau basa kuat.


No comments:
Post a Comment